国内首款新冠 mRNA 疫苗登场;恒瑞继续申报眼科新药;信达双靶降糖药进攻 NASH 适应症… | Insight 新药周报


据 Insight 数据库统计,本周(3 月 19 日-3 月 25 日)全球共有 29 款创新药(含改良新)研发进度推进到了新阶段,其中 7 获批上市,3 款申报上市,7 款获批临床,9 款申报临床。
下文中,Insight 将分别摘取国内外部分重点项目做介绍。

国内创新药进展
国内部分,本周共有 26 款创新药(含改良新)研发进度推进到了新阶段,其中 5 款获批上市,2 款申报上市,4 款获批临床,11 款申报临床。
本周国内首次启动临床的 2款创新药(含改良新)
来自:Insight 数据库网页版()
以下图片如无特殊说明,均来自 Insight 数据库
获批上市
1、国内首款:石药集团新冠 mRNA 疫苗获批紧急使用
3 月 22 日,正值石药集团 2022 年度财报公布之际,同时发布的还有其新冠 mRNA 疫苗 SYS6006 纳入紧急使用的信息。
SYS6006 为石药自主研发涵盖 Omicron BA.5 突变株核心突变位点的广谱抗变异毒株 mRNA 疫苗,尽管并非国内首位布局者,但 SYS6006 获批紧急使用后超车成为了国内进度第一位。
据 Insight 数据库显示,2022 年 4 月 4 日 SYS6006 在国内首次获批临床,随后自同月 21 日开始启动临床试验,迄今已在中国完成I、II 期和序贯加强免疫临床研究,通过超5500 人的临床研究结果证明了其安全性、免疫原性和保护效力。

截图来自:Insight 数据库网页版
()
安全性方面,SYS6006 的各种不良事件发生率较低且程度较轻,主要不良事件为发热、注射部位疼痛,且主要为 1、2 级。相比于成年组,老年组的不良事件发生率及严重程度大幅降低,在老年人群中具有更好的风险获益比。
免疫原性方面,加强接种 1 剂 SYS6006 后,14 天的针对 Omicron BA.5 中和抗体的几何平均滴度 (GMT) 为 236,是加强接种前的 83 倍。在灭活疫苗 2 剂或 3 剂基础上接种 1 剂 SYS6006 的序贯加强免疫,SYS6006 显示出对 Omicron BA.5、BF.7、BQ.1.1、XBB.1.5、CH.1.1 毒株有很好的交叉中和作用。临床研究结果表明,无论是基础免疫,还是序贯加强免疫,SYS6006 都可以持续诱导针对野生株、Delta、Omicron BA.2 和 BA.5 株的特异性 T 细胞免疫,并在较长时间内维持高水平,且针对不同毒株的细胞免疫强度大致相当。
保护效力方面,在疫情期间(2022.12.10- 2023.1.18)开展的4000 例序贯加强免疫临床研究(研究编号:SYS6006-008)中,以重组蛋白疫苗为对照,观察加强接种后 7-28 天,SYS6006 的保护效力为 70.2%(95% CI:53.6% - 80.9%);观察加强接种后 14-28 天,SYS6006 的保护效力为 85.3%(95% CI:56.9% - 95.0%)。
SYS6006 临床数据
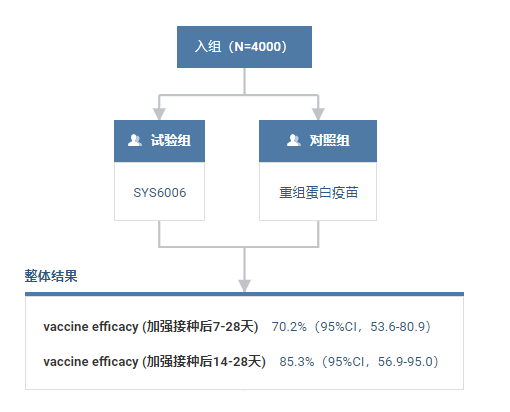
截图来自:Insight 数据库网页版
值得一提的是,mRNA 疫苗的一大优势就是基于变异株的研发迭代速度更快、更灵活。石药在公告中也同样表示,将充分考虑当前新冠病毒变异特性,预测未来毒株的变异趋势,推进针对新变异株的迭代新冠 mRNA 疫苗的研发,并积极推动该平台上其他产品的开发进程。同时,SYS6006 还克服了稳定性问题,可在 2-8°C 长期贮藏。
尽管严峻的疫情形势已经过去,但创新疫苗、二代疫苗以及新冠抗病毒药物的获批,仍然在为后续可能的变异株和反复情况提供足够的武器弹药储备。
2、无需联用利托那韦!众生药业新冠口服药获批上市
3 月 23 日,国家药监局发布公告宣布,附条件批准广东众生睿创生物科技有限公司申报的 1 类创新药来瑞特韦片(商品名称:乐睿灵)上市。来瑞特韦片为口服小分子新冠病毒感染治疗药物,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。
值得一提的是,来瑞特韦是国内首款获批治疗新冠的单药 3CL 蛋白酶抑制剂,无需联用利托那韦,独具优势。
此前,国内已经获批 5 款新冠抗病毒口服化药:阿兹夫定(真实生物)、奈玛特韦/利托那韦(Paxlovid,辉瑞)、莫诺拉韦(Molnupiravir,默沙东)、瑞米德韦(VV116,君实生物)、先诺特韦/利托那韦(SIM0417,先声药业)。
其他国产抗病毒药详情回顾 >>
来瑞特韦片通过作用于新型冠状病毒(SARS-Cov-2)的 3CL 蛋白酶,抑制病毒多聚前体蛋白的切割,进而阻断病毒复制,达到抗新冠病毒的作用。来瑞特 韦片在野生株、阿尔法、贝塔、德尔塔、奥密克戎(包括 BA.5、BF.7)等多种 新冠病毒感染的细胞模型中,可以有效抑制新冠病毒复制,展现了广谱抗新冠病 毒的能力。
此前已完成的 I 期临床研究提示来瑞特韦片具有良好安全性和耐受性;一项研究 者发起、来瑞特韦片治疗新冠感染患者的剂量探索性研究中,提示来瑞特韦片单 药组或联合利托那韦组均较安慰剂组可快速降低新冠病毒 RNA 载量和显著缩短 病毒核酸转阴时间(二者均有统计学显著性差异)。
2022 年 11 月 13 日,来瑞特韦片治疗轻型和普通型 SARS-CoV-2 感染患者的 随机、双盲、安慰剂对照 III 期临床研究完成首例受试者入组和给药;2022 年 12 月 30 日,完成在广东、北京、山东、河南、江苏、湖北、内蒙古、江西、海南 等全国多个省市区的 33 家临床研究中心开展竞争性入组,修订后方案计划入组 1344 例新冠感染患者,实际完成随机入组 1359 例。
III 期临床研究入选人群包括伴或不伴高危因素的轻型和普通型 SARS-CoV-2 感染患者,给药方案为来瑞特韦片 400 mg 单药,连续口服 5 天,研究主要疗效终点指标为新冠感染患者 11 项临床症状/体征均持续恢复正常的时间。当前,来瑞特韦片的临床研究已达到方案预设的事件数,数据管理和统计分析结果提示,本研究已达到方案预设的主要疗效终点指标,不良事件发生率与安慰剂组相当,安全性良好。
3、阿斯利康 BTK 抑制剂「阿克替尼」国内获批上市
3 月 22日,NMPA 批件显示,阿斯利康的 BTK 抑制剂「阿可替尼胶囊」获批上市(受理号:JXHS2101107)。
阿可替尼最早在 2017 年 10 月 31 日在美国获批上市,商品名为 Calquence;随后又在 2020 年 11 月和 2021 年 1 月陆续在欧盟和日本获批。目前该药已获批慢性淋巴细胞白血病、小淋巴细胞淋巴瘤、套细胞淋巴瘤适应症。据 Insight 数据库显示,当前阿可替尼全球销售额还在高速增长中,2022 年度同比增长 66.16% 达到 20.57 亿美元。
阿可替尼全球销售额趋势
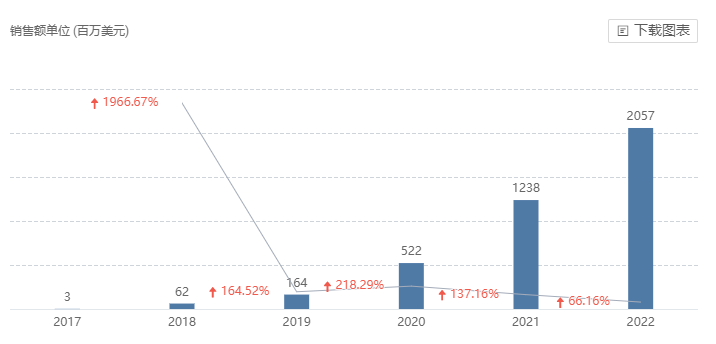
截图来自:Insight 数据库网页版
()
阿斯利康于 2022 年 1 月在中国递交该药的上市申请,经过一年审批,如今终于获批上市。
国内历史审评时光轴
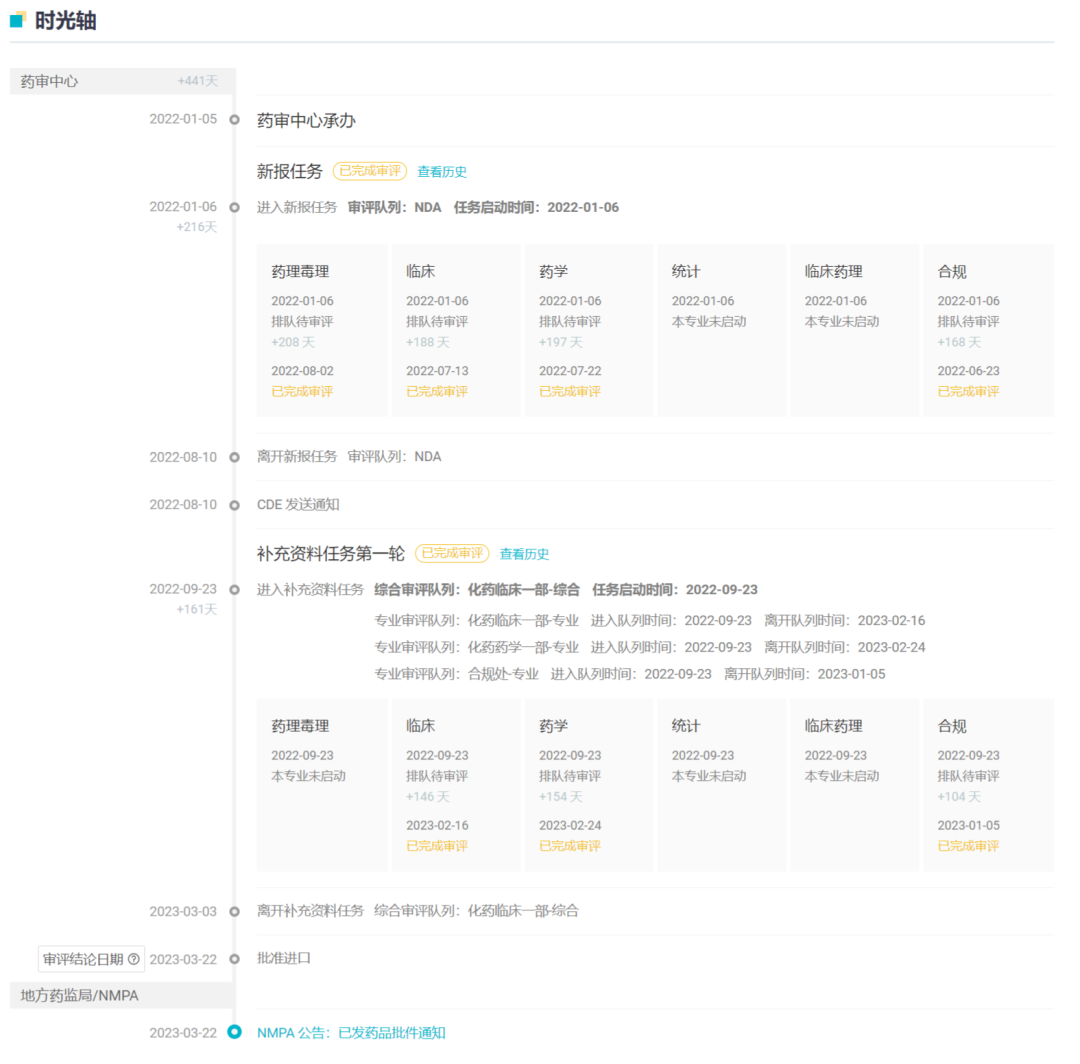
截图来自:Insight 数据库网页版
在中国,当前已有 4 款 BTK 抑制剂获批上市。进口国产各两款:伊布替尼(强生制药)、阿可替尼(阿斯利康)、泽布替尼(百济神州)、奥布替尼(诺诚健华)。
申报上市
1、恒瑞医药:又一款干眼病新药申报上市,眼科领域持续加注
3 月 20 日,恒瑞医药宣布,干眼病新药 SHR8028(环孢素滴眼液)的药品上市许可申请已获国家药监局受理,申请上市的适应症为:治疗干眼的体征和症状。
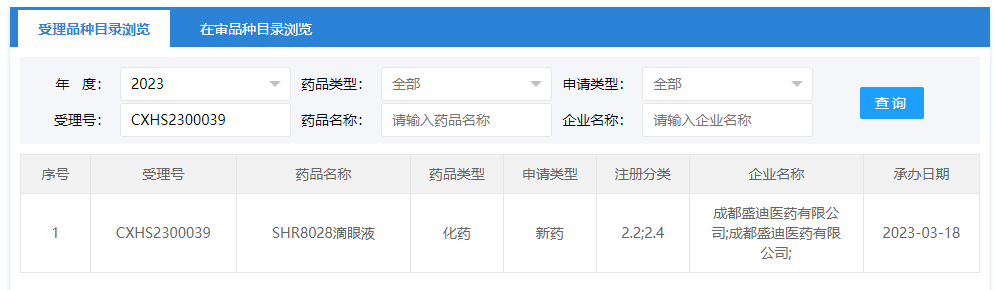
截图来自:CDE 官网
此次申报上市,是基于一项多中心、随机、对照、双盲的 Ⅲ 期临床研究(研究编号 SHR8028-301)。这项研究纳入 206 例中重度干眼病患者,研究结果表明,与赋形剂对比,SHR8028 滴眼液可以显著改善患者的干眼病症状和体征。同时,SHR8028 滴眼液安全可靠,局部耐受性好,不良事件和滴药后局部感觉异常的发生率与赋形剂相当。
SHR8028 滴眼液是恒瑞医药从德国 Novaliq GmbH 公司引进的 CyclASol®(0.1% 环孢素 A 制剂),是一种抗炎和免疫调节剂。环孢素(CsA)是一种高效、选择性的免疫抑制药物,被广泛用于治疗 T 细胞介导的眼表疾病,如干眼病。作为一种具有抗炎特性的免疫调节药物,其相关研究已经具有一定进展,能够减少炎症标志物并降低升高的泪膜渗透压,具有良好的临床效果。
SHR8028 滴眼液使用了半氟化烷烃(SFA)这种全新的 EyeSol®无水药物递送平台。使用半氟化烷烃的全氟丁基戊烷(F4 H5)作为溶剂,能够增加环孢素在 SHR8028 滴眼液中的溶解,其物理特性使其成为局部眼用制剂的最佳溶剂。SHR8028 产品不含油、表面活性剂和防腐剂,潜在优势包括局部生物利用度高、起效快、局部耐受性好等,减少油性眼药水、乳剂或软膏相关的视觉干扰。
SHR8028 目前已完成多个临床试验,恒瑞合作方 Novaliq 公司已于 2022 年 8 月向美国 FDA 提交 NDA 上市申请,拟申请适应症「治疗干眼的体征和症状」,目前正在接受 FDA 上市申请审查。
恒瑞近年来在眼科领域布局频频,令人瞩目。今年 2 月 1 日,恒瑞另一款干眼病药物SHR8058 滴眼药刚刚申报上市(受理号:CXHS2300021),用于治疗睑板腺功能障碍相关干眼病。
SHR8058 滴眼液是一种无色、透明的滴眼液,由 100% 全氟己基辛烷组成,能迅速扩散至整个眼表,并与泪膜的亲脂部分相互作用,稳定泪膜、防止泪液过度蒸发。此外,SHR8058 滴眼液可穿透睑板腺,与腺体相互作用并溶解腺体中的粘性分泌物,从而达到治疗睑板腺功能障碍相关蒸发过强型干眼病的作用。
SHR8058 滴眼液同样是恒瑞 2019 年 11 月从 Novaliq GmbH 公司引进的产品,两款药物首付款就高达 600 万美元。SHR8058 原研发代号为 NOV03(全氟己基辛烷)。据 Insight 数据库显示,SHR8058 于 2020 年 12 月在国内首次获批临床,于 2021 年 1 月首次启动临床(登记号:CTR20210154)。
SHR8058 全球开发项目重要节点
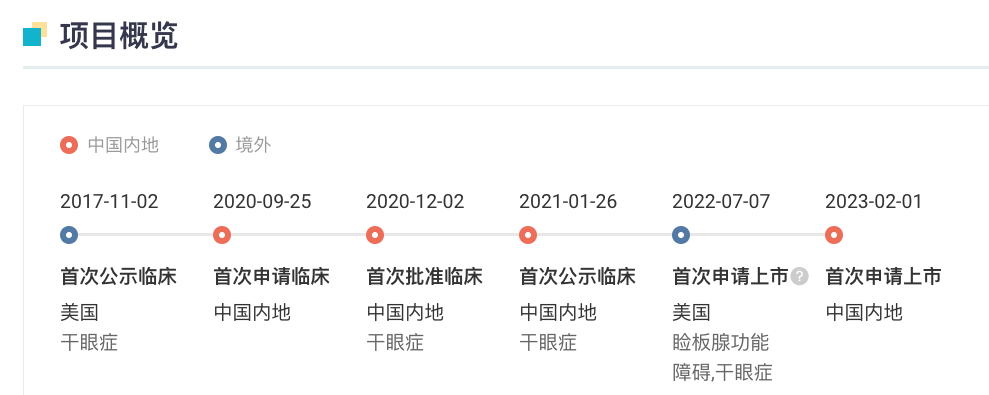
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
除干眼症外,恒瑞在近视领域也有所布局。其在研近视眼药物 HR19034 当前也已在开展 II/III 期临床试验(登记号:CTR20212080),用于延缓儿童近视进展,并于去年 12 月完成所有受试者的招募工作。
HR19034 的活性成分主要通过与巩膜、脉络膜、视网膜的相关受体相互作用,抑制眼轴增长,从而延缓近视进展。目前,国内外尚未有同类产品获批上市。
CTR20212080临床试验历史时光轴
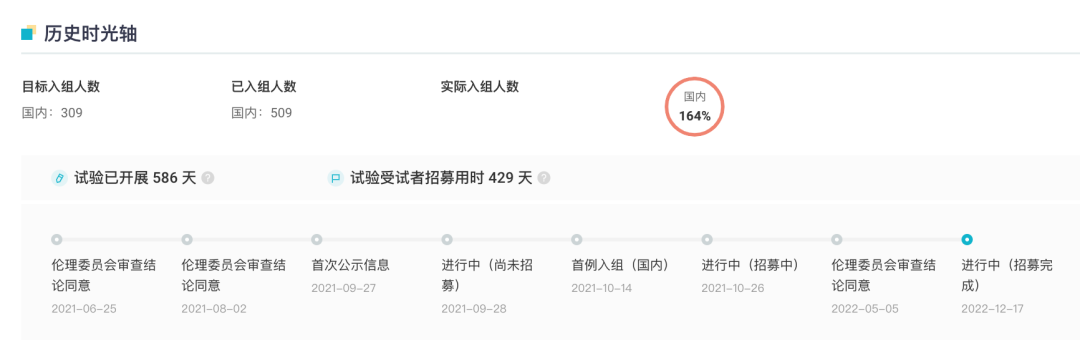
来自:Insight 数据库网页版
根据灼识资料,预计全球眼科药物市场将由 2019 年的 340 亿美元增至 2030 年的 681 亿美元,恒瑞无疑也看好该市场,除创新药外,还布局了多款首仿眼科产品,适应症涵盖干眼症、青光眼等。
2021 年 11 月,恒瑞首仿药「他氟前列素滴眼液」获批,用于治疗青光眼;2022 年 5 月,首仿药「地夸磷索钠滴眼液」获批,用于治疗干眼病;此外,恒瑞「去氧肾上腺素酮咯酸溶液」也是国内首家报上市产品,当前已完成审评工作(受理号:CYHS2000851)。
2、海创药业:二代 AR 拮抗剂申报上市
3 月 23 日,据 CDE 官网显示,海创药业德恩鲁胺(HC-1119)申报上市,拟用于经醋酸阿比特龙或多西他赛治疗失败,不可耐受或不适合多西他赛治疗的转移性去势抵抗性前列腺癌(mCRPC)患者。
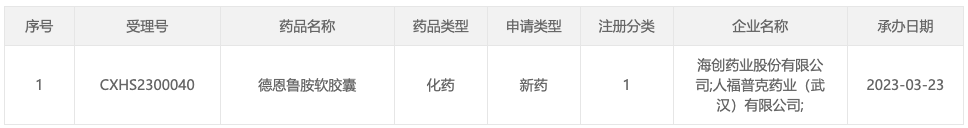
来自:CDE 官网
德恩鲁胺(HC-1119)是海创药业自主研发的 1 类新药,是第二代雄激素受体(AR)拮抗剂恩扎卢胺的氘代药物。
2022 年 6 月,海创药业宣布德恩鲁胺(HC-1119)二三线治疗转移性去势抵抗性前列腺癌(mCRPC)中国患者的多中心、随机、双盲、安慰剂对照的 III 期临床 HC-1119-04 试验(登记号:NCT03851640)完成了预设的期中分析,独立数据监查委员会(IDMC)对结果审核后判定试验达到预设的主要研究终点。
该研究结果显示,HC-1119 软胶囊整体安全性良好,经其治疗后的影像学无进展生存期(rPFS)达到预期并且具有显著统计学意义,可以显著降低转移性去势抵抗性前列腺癌患者的疾病进展风险;总生存时间(OS)已观察到临床获益趋势并可以降低患者死亡风险。
德恩鲁胺(HC-1119)作为第二代 AR 抑制剂,可竞争性抑制雄激素与 AR 结合,阻断 AR 信号通路的传递,抑制前列腺癌细胞增殖,诱导前列腺癌细胞凋亡。据海创药业新闻稿,与已上市同类药物相比,此前临床及临床前结果显示,德恩鲁胺(HC-1119)具有有效性高、安全性好、病人依从性更强的潜力,且其化合物专利将于 2032 年到期,专利有效期更长。
对经醋酸阿比特龙和多西他赛治疗失败或不可耐受或不适合多西他赛治疗的 mCRPC 患者,目前国内暂无药物获批,德恩鲁胺(HC-1119)本次中国 III 期临床针对此类患者展开,预期在上市后将为临床治疗提供全新治疗选择,并在国内市场获得差异化竞争优势。
获批临床
信达生物:双靶降糖药拓展 NASH 适应症
3 月 22 日,CDE 官网显示,信达生物 IBI362 新适应症获批临床,用于非酒精性脂肪性肝炎(NASH)。
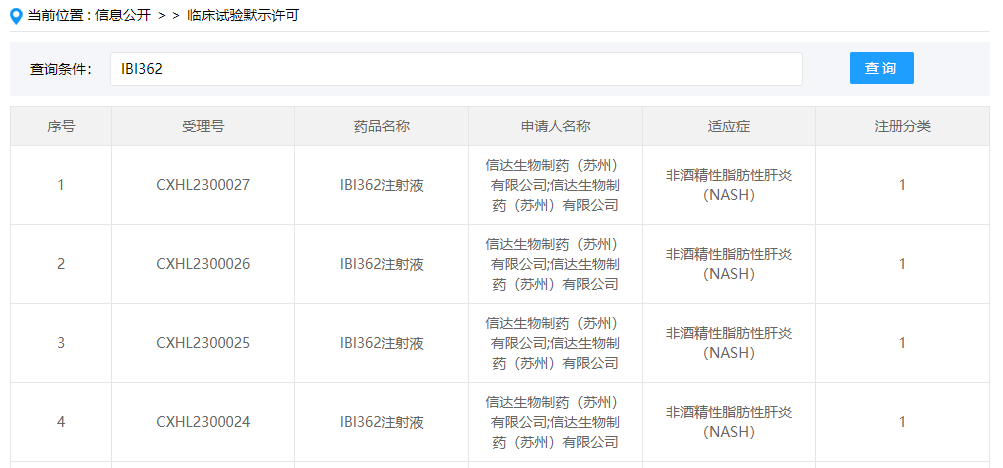
截图来自:CDE 官网
IBI362 是国内企业进展最快的 GLP-1 类双靶降糖药,靶点为 GLP-1R/GCGR。该药是与礼来共同开发的产物,协议于 2019 年 8 月签订。当前,IBI362 已经在2 型糖尿病和肥胖症领域双线布局,均推进到 3 期临床。
IBI362权益流转图

截图来自:Insight 数据库网页版()
信达的 3 项 III 期临床几乎在 2022 年 10 - 11 月同步登记。本次 NASH 适应症获批临床,意味着该药又将适应症版图扩大,拓展到了颇具挑战的新领域。
IBI362 3 项 III 期临床已经启动
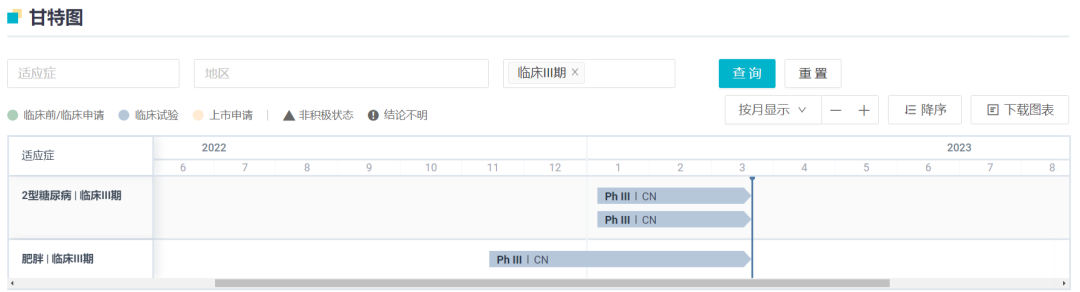
截图来自:Insight 数据库网页版
Insight 曾撰文介绍这 3 项临床试验情况,梳理 3 项 III 期临床试验详情和 IBI362 既往 II 期证据,点此回顾 >>
而关于 GLP-1 类药物重点集火的肥胖症赛道,本周 Insight 发布自研行业报告,梳理其竞争格局和市场前景。报告免费下载通道可戳 >>

境外创新药进展
境外部分,本周共有 13 款创新药(含改良新)研发进度推进到了新阶段,其中 4 获批上市,2 款申报上市,4 款获批临床,3 款申报临床。
获批上市
1、赛诺菲:「度普利尤单抗」新适应症获欧盟批准
3 月 21 日,赛诺菲宣布其在研「度普利尤单抗」获欧盟批准,用于治疗患有重度特应性皮炎的 6 个月~5 岁儿童患者,成为欧洲首个也是唯一一个用于治疗该类儿童患者的靶向药物。

来自:赛诺菲官网
该项适应症的批准,主要基于一项 III 期临床试验的数据。该研究共纳入了 162 名 6 个月~ 5 岁患有中重度特应性皮炎的儿童患者。
结果表明,在第 16 周时,与安慰剂相比,接受 Dupixent 治疗的患者改善了皮肤清除率并降低了总体疾病严重程度和瘙痒。在患有严重特应性皮炎的患者亚组中,在 16 周时,与安慰剂组相比,随机分配接受 Dupixent 治疗的患者经历了以下情况:
与安慰剂相比,Dupixent 还改善了总体人群和严重人群的睡眠质量、皮肤疼痛和与健康相关的生活质量。长期疗效数据显示 16 周时的临床获益持续到 52 周。
在安全性方面,最常见的副作用包括注射部位反应、结膜炎、过敏性结膜炎、关节痛、口腔疱疹和嗜酸性粒细胞增多等。
度普利尤单抗(Dupilumab)是赛诺菲与再生元合作开发的一款人源性单克隆抗体,靶向 IL-4Rα。通过结合 IL-4Rα,度普利尤单抗可同时阻断 IL-4 和 IL-13 信号通路,IL-4 和 IL-13 被认为是特应性皮炎持续性炎症的主要驱动因子。
2017 年 3 月,度普利尤单抗获 FDA 批准成为首个用于治疗成人中重度特应性皮炎的靶向生物药,商品名为 Dupixent®,上市首年即实现销售额 2.51 亿美元。此后,Dupixent 又先后获批了哮喘、鼻息肉适应症,2019 年其全球销售额为 23.13 亿美元,涨幅高达 150%。销售额仍维持着高涨幅,2021 年销售额达到 61.92 亿美元,在全球药品销售额 TOP 榜上稳坐前列。2022 年又连续获批结节性痒疹、婴幼儿特应性皮炎以及嗜酸性食管炎适应症,且还在拓展其他适应症,市场前景可观。
度普利尤单抗全球销售额
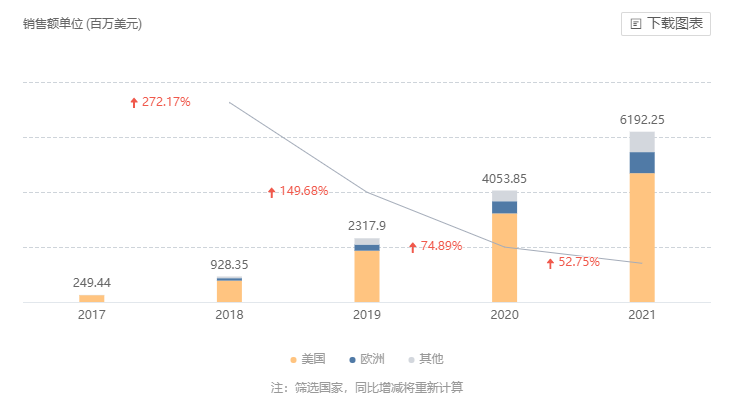
来自:Insight 数据库网页版
据 Insight 数据库显示,当前 MK-7684A 正在开展 5 项 III 期临床研究,除 NSCLC 外,另有针对小细胞肺癌以及黑色素瘤。
2、再鼎医药引进:Incyte PD-1 单抗获 FDA 批准上市
3 月 22 日,Incyte 宣布其在研 PD-1 抗体 Retifanlimab 获 FDA 批准上市,用于治疗转移性或复发性局部晚期默克尔细胞癌(MCC)成人患者,商品名为 Zynyz。
来自:Incyte 官网
FDA 的批准基于 POD1UM-201 试验的数据,该试验是一项开放标签、单臂研究,旨在评估 Retifanlimab在患有转移性或复发性局部晚期 MCC 且未接受过晚期疾病全身治疗的成人患者中的疗效。
结果显示,在未接受过化疗的患者(n = 65)中,Retifanlimab单药治疗的客观缓解率 (ORR)为 52%(95% CI:40-65),其中,12 名患者(18%)出现完全缓解,22 名患者 (34%) 出现部分缓解。在缓解的患者中,缓解持续时间(DOR)从 1.1 个月到 24.9 个月不等,76% (26/34)患者的 DOR 为 6 个月或更长时间,62%(21/34)患者的 DOR 超过 12 个月。
在安全性方面,22% 接受 Retifanlimab治疗的患者发生严重不良反应。最常见的严重不良反应(≥ 2% 的患者)为疲劳、心律失常和肺炎。11% 的患者因不良反应永久停用 Retifanlimab。
Retifanlimab 的美国上市进程不算顺利,此前该药曾在另一适应症肛管鳞状细胞癌(SCAC)上收到 FDA 的 CRL,不过如今总算正式走上了商业化之路。
Retifanlimab 的大中华区权益属于再鼎医药,2019 年度,两家公司达成了合作,再鼎以1750 万美元首付款 + 最高 6000 万美元的潜在开发、注册和商业里程碑付款 + 销售分成获得了该药的独家开发和商业化权益。
申报上市
国产 PD-1 继续谋出海:复宏汉霖「斯鲁利单抗」欧洲报上市
3 月 24 日,复宏汉霖宣布,PD-1 单抗斯鲁利单抗(H 药,中国商品名:汉斯状®)联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)的上市许可申请(MAA)获欧洲药品管理局(EMA)受理。2022 年 12 月,H 药治疗小细胞肺癌(SCLC)获得欧盟委员会(EC)授予的孤儿药资格认定。
斯鲁利单抗是全球首个在小细胞肺癌适应症上取得成功的 PD-1 单抗。本次上市申请提交后,该药成为了第 3 款在欧洲报上市的国产 PD-1 单抗。
国产 PD-1 单抗海外申报表